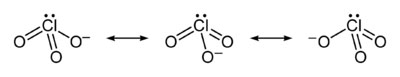
کلرات (Chlorate) نام رایج بنیان ClO− است. سه آنیون که اتم کلر آن در حالت اکسیداسیون 5+ است. این اصطلاح همچنین می تواند به ترکیبات شیمیایی حاوی این آنیون اشاره داشته باشد که کلرات ها نمک های اسید کلریک هستند.
سایر اکسیدایونهای کلر را میتوان «کلرات» نامید و به دنبال آن یک عدد رومی در پرانتز نشاندهنده وضعیت اکسیداسیون کلر است: به عنوان مثال، ClO−چهار یونی که معمولاً پرکلرات نامیده می شود را می توان کلرات (VII) نیز نامید.
پس همانطور که گفتیم کلرات (ClO₃⁻) آنیونی است که یکی از چندین اکسیدایونهای کلر است که در شیمی کاربرد دارند. در ادامه، به توضیحاتی پیرامون این آنیون و ترکیبات مربوطه میپردازیم:
عناوین مطالب مقاله
از نقطه نظر میکروبی، وجود کلرات طبیعی میتواند توضیح دهد که چرا انواع میکروارگانیسمها قادر به احیای کلرات به کلرید هستند. این موضوع نشان میدهد که تکامل احیای کلرات ممکن است یک پدیده باستانی باشد، زیرا همه باکتریهای کاهنده پرکلرات که تاکنون شناسایی شدهاند.
از کلرات به عنوان گیرنده الکترون پایانی استفاده میکنند. در حال حاضر، هیچ کانی غالب کلرات شناخته نشده است، اما وجود این ترکیبات در طبیعت اهمیت زیادی دارد.
کشف ذخایر طبیعی کلرات
مطالعهای در سال 2010 وجود ذخایر طبیعی کلرات در سراسر جهان را کشف کرد که نشان داد این ترکیبات در مناطق خشک و فوقخشک با غلظتهای نسبتاً بالایی یافت میشوند. علاوه بر این، کلرات در نمونههای بارندگی نیز با مقادیر مشابه پرکلرات اندازهگیری شده است. این امر نشان میدهد که کلرات و پرکلرات ممکن است یک مکانیسم تشکیل طبیعی مشترک داشته باشند و بخشی از چرخه بیوژئوشیمیایی کلر باشند.
در سال 2011، مطالعهای توسط موسسه فناوری جورجیا از وجود کلرات منیزیم در سیاره مریخ پرده برداشت. این یافتهها نشان میدهند که کلراتها در محیط های فرازمینی نیز وجود دارند و میتوانند نقش مهمی در شیمی مریخ ایفا کنند. اگرچه کلراتها نسبتاً سمی هستند، اما در صورت احیا، کلریدهای بیضرری را تشکیل میدهند که میتوانند برای حیات میکروبی محتمل مفید باشند.
انواع کلراتها
کلراتها (Chlorates) به ترکیباتی گفته میشود که شامل آنیون کلرات (ClO₃⁻) هستند. این ترکیبات به دلیل خواص اکسیدکنندگی قویشان در صنایع مختلف کاربرد دارند. در ادامه، به معرفی برخی از مهمترین کلراتها پرداخته میشود:

کلرات پتاسیم (KClO₃):
- فرمول شیمیایی: KClO₃
- ویژگیها: کلرات پتاسیم به صورت پودر سفید یا بلورهای شفاف یافت میشود.
- کاربردها: به عنوان اکسیدکننده در آتشبازی، مواد منفجره، کبریت و تولید اکسیژن در آزمایشگاهها استفاده میشود.
کلرات سدیم (NaClO₃):
- فرمول شیمیایی: NaClO₃
- ویژگیها: کلرات سدیم به صورت پودر سفید یا بلورهای شفاف یافت میشود.
- کاربردها: در کشاورزی به عنوان علفکش، در صنایع کاغذ و خمیرکاغذ به عنوان سفیدکننده، و در صنعت تولید دیاکسید کلر استفاده میشود.
کلرات منیزیم (Mg(ClO₃)₂):
- فرمول شیمیایی: Mg(ClO₃)₂
- ویژگیها: کلرات منیزیم به صورت پودر سفید یا بلورهای شفاف یافت میشود.
- کاربردها: به دلیل خواص اکسیدکنندگی، در برخی کاربردهای خاص صنعتی استفاده میشود و همچنین به عنوان منبع کلرات در تحقیقات علمی کاربرد دارد.
کلرات کلسیم (Ca(ClO₃)₂):
- فرمول شیمیایی: Ca(ClO₃)₂
- ویژگیها: کلرات کلسیم به صورت پودر سفید یا بلورهای شفاف یافت میشود.
- کاربردها: به عنوان اکسیدکننده در صنایع مختلف و به عنوان ماده ضدعفونیکننده استفاده میشود.
کلرات باریم (Ba(ClO₃)₂):
- فرمول شیمیایی: Ba(ClO₃)₂
- ویژگیها: کلرات باریم به صورت پودر سفید یا بلورهای شفاف یافت میشود.
- کاربردها: به عنوان اکسیدکننده در مواد آتشبازی و تولید دیاکسید کلر کاربرد دارد.
کلراتها اکسیدانهای قوی هستند، به این معنی که میتوانند به راحتی با سایر مواد واکنش نشان دهند و آنها را اکسید کنند. آنها همچنین میتوانند انفجاری باشند، به خصوص زمانی که با مواد قابل احتراق مخلوط شوند.
به دلیل ماهیت خطرناک آنها، استفاده از کلرات ها در برخی کشورها محدود شده است.
تهیه کلراتها
الکترولیز محلولهای کلریدی مانند کلرید سدیم یا کلرید پتاسیم یکی از روشهای معمول برای تولید کلراتها است.
در این فرایند، با اعمال جریان الکتریکی به محلول کلریدی، کلریدها به کلر گاز و یونهای هیدروکسید یا اکسیژن در کاتد (سطح منفی) و آند (سطح مثبت) تجزیه میشوند. کلر گاز تشکیل شده سپس با آب تداخل کرده و اکسیژن آزاد را تولید میکند. این اکسیژن سپس به ترکیبات کلراتی اکسید میشود، که میتوانند با فلزات قلیایی مانند سدیم و پتاسیم و یا با فلزات آلی مانند منیزیم و کلسیم ترکیب شوند.
این روش یکی از روشهای موثر و اقتصادی برای تولید کلراتهاست و در صنایع مختلف از جمله صنایع شیمیایی، کشاورزی و آتشبازی استفاده میشود.
۱. تهیه کلرات سدیم:
- الکترولیز محلول کلرید سدیم (NaCl) با استفاده از یک سلول الکترولیز.
- تولید کلر گاز در آند و هیدروکسید سدیم (NaOH) در کاتد.
- تداخل کلر گاز با آب، که موجب تولید کلرات سدیم (NaClO₃) میشود.
۲. تهیه کلرات پتاسیم:
- الکترولیز محلول کلرید پتاسیم (KCl) با استفاده از یک سلول الکترولیز.
- تولید کلر گاز در آند و هیدروکسید پتاسیم (KOH) در کاتد.
- تداخل کلر گاز با آب، که موجب تولید کلرات پتاسیم (KClO₃) میشود.
۳. تهیه کلرات منیزیم یا کلرات کلسیم:
- از راههای شیمیایی دیگر میتوان به راه حل کلرید منیزیم (MgCl₂) یا کلرید کلسیم (CaCl₂) با کلرات سدیم یا کلرات پتاسیم و تشکیل کلرات منیزیم (Mg(ClO₃)₂) یا کلرات کلسیم (Ca(ClO₃)₂) اشاره کرد.
به طور کلی، تهیه کلراتها معمولاً نیازمند تکنیکهای خاص شیمیایی یا الکترولیزی است و باید با دقت و به روشهای ایمن انجام شود.
مشخصات کلی کلرات ها
| خاصیت | توضیحات |
|---|---|
| فرمول شیمیایی | ClO3- |
| حالت فیزیکی | جامد، مایع یا گاز (بسته به نوع فلز) |
| رنگ | بی رنگ، سفید یا … (بسته به نوع فلز) |
| حلالیت | بسیار محلول در آب |
| طعم | شور و تند |
| بو | تند |
| اکسیداسیون | اکسیدان قوی |
ویژگیهای مشترک کلراتها
- اکسیدکنندگی قوی: کلراتها به دلیل توانایی بالای اکسیدکنندگیشان در صنایع مختلف از جمله تولید مواد منفجره، آتشبازی و سفیدکنندهها استفاده میشوند.
- خطر انفجار: به دلیل ناپایداری و حساسیت به حرارت و ضربه، کلراتها باید با دقت زیادی حمل و نگهداری شوند.
- تجزیه به کلریدها: در شرایط احیا، کلراتها به کلریدهای بیضرر تجزیه میشوند.
اکسیداسیونهای کلر
کلر میتواند در اکسیداسیونهای مختلفی حضور داشته باشد و اکسیدهای مختلفی را تشکیل دهد. این اکسیدها شامل:
- هیپوکلریت (ClO⁻): کلر در حالت اکسیداسیون +1 قرار دارد.
- کلریت (ClO₂⁻): کلر در حالت اکسیداسیون +3 قرار دارد.
- کلرات (ClO₃⁻): کلر در حالت اکسیداسیون +5 قرار دارد.
- پرکلرات (ClO₄⁻): کلر در حالت اکسیداسیون +7 قرار دارد.
هر یک از این اکسیدها فرمول و نام خاصی دارند و در شرایط و محیطهای مختلف، واکنشهایی مختلفی از خود نشان میدهند. این اکسیدها از نظر شیمیایی و بیولوژیکی، کاربردها و خواص مختلفی دارند و در صنایع مختلف از جمله صنایع شیمیایی، پزشکی، آب و فاضلاب، آرایشی و بهداشتی، و غیره استفاده میشوند.
کاربردهای کلرات ها
کلراتها به عنوان ترکیبات شیمیایی با خواص اکسیدکننده و کاربردهای متعدد در صنایع مختلف مورد استفاده قرار میگیرند. برخی از کاربردهای مهم کلراتها عبارتند از:
۱. تولید آتشبازیها و مواد پیروتکنیک: کلراتها، به ویژه کلرات پتاسیم، در تهیه آتشبازیها و مواد پیروتکنیکی مورد استفاده قرار میگیرند. آتشبازیها، مواد منفجره و بسیاری از آیتمهای جشنها و مراسمات از این ترکیبات استفاده میکنند.

۲. صنایع کاغذ و نساجی: کلرات سدیم به عنوان ماده سفیدکننده در صنایع کاغذسازی و نساجی استفاده میشود. این ترکیبات بهبود رنگ و لطافت محصولات نهایی را افزایش میدهند.
۳. کشاورزی: کلراتها، به ویژه کلرات پتاسیم، به عنوان عمده ترکیباتی در کودهای کشاورزی مورد استفاده قرار میگیرند. این ترکیبات میتوانند بهبود رشد و عملکرد گیاهان را تسریع بخشند.
۴. صنایع شیمیایی و فلزی: کلراتها در صنایع مختلف شیمیایی و فلزی برای تولید مواد شیمیایی و فرآوردههای فلزی مورد استفاده قرار میگیرند. این ترکیبات میتوانند به عنوان منبع اکسیداسیون در فرآیندهای شیمیایی و فرآیندهای تولید فلزات استفاده شوند.
۵. تولید داروها و مواد ضدعفونی: برخی از کلراتها در صنایع داروسازی و تولید مواد ضدعفونی مورد استفاده قرار میگیرند. این ترکیبات میتوانند به عنوان مواد آغازین در تولید داروهای ضد باکتری و ضد میکروب استفاده شوند.
۶. استفاده در آزمایشگاه: کلراتها به عنوان منابع اکسیژن در آزمایشگاهها مورد استفاده قرار میگیرند. این ترکیبات میتوانند در فرآیندهای شیمیایی و آزمایشی به عنوان اکسیدکنندهها یا منابع اکسیژن استفاده شوند.
در کل، کلراتها به دلیل خواص اکسیدکننده و کاربردهای گسترده در صنایع مختلف، مواد بسیار مهمی در علم و صنعت هستند.
نکات ایمنی در هنگام کار با کلرات ها
هنگام کار با کلراتها، رعایت نکات ایمنی بسیار مهم است زیرا این ترکیبات میتوانند با خواص اکسیدکنندهشان، خطراتی برای سلامتی افراد و محیط زیست ایجاد کنند. برخی از نکات ایمنی در هنگام کار با کلراتها عبارتند از:
۱. محیطهای تهویه: هنگامی که با کلراتها کار میکنید، اطمینان حاصل کنید که در محیطی با مهویت مناسب قرار دارید. استفاده از ماسک تنفسی و سیستم تهویه میتواند از تنفس بخارات یا ذرات جامد کلراتها جلوگیری کند.
۲. استفاده از لباس و دستکش: هنگام تعامل با کلراتها، لباسهای مناسب و دستکشهای محافظ را استفاده کنید تا پوست و لباسهایتان از تماس مستقیم با این مواد محافظت شود.
۳. استفاده از عینک و ماسک: استفاده از عینک محافظ و ماسک چشمی میتواند از برخورد مستقیم با این مواد و ورود ذرات به چشمها جلوگیری کند.
۴. استفاده در محیطهای مناسب: کار با کلراتها در محیطهای مناسب و با تجهیزات ایمنی مربوطه صورت بگیرد. اطمینان حاصل کنید که در محلی با وسایل اطفاء حریق مناسب و دسترسی آسان به فرارگاهها کار میکنید.
۵. انتقال محصولات با احتیاط: هنگام انتقال و ذخیره کلراتها، از بستهبندی مناسب و انتقال با احتیاط استفاده کنید تا خطرات برای شما و دیگران کاهش یابد.
۶. اطلاعات و آموزش: اطمینان حاصل کنید که کارگرانی که با کلراتها کار میکنند، دارای آموزشهای لازم درباره استفاده صحیح، ذخیرهسازی و ایمنی این ترکیبات هستند.
همچنین، همواره مواد ایمنی و اورژانسی مانند آب و صابون و ضایعات حادثه نگهداری شوند و در صورت بروز هر گونه حادثه، به طور فوری اقدامات لازم انجام شود.
تولید صنعتی کلرات سدیم
تولید صنعتی کلرات سدیم معمولاً از طریق فرایند الکترولیز محلول کلرید سدیم (نمک معمولی) انجام میشود. این فرایند به طور خلاصه به صورت زیر است:
- تهیه محلول کلرید سدیم: ابتدا محلول کلرید سدیم از طریق حل کلرید سدیم در آب تهیه میشود. این محلول غلیظ در مقادیر مشخص و به طور دقیق محاسبه شده است.
- الکترولیز: محلول کلرید سدیم در یک سلول الکترولیزی قرار میگیرد. در این سلول، با استفاده از جریان الکتریکی، یونهای کلرید (Cl⁻) به سمت آند (سرکان) و یونهای سدیم (Na⁺) به سمت کاتد (قطب) جا به جا میشوند.
- تولید کلر گاز و هیدروکسید سدیم: در سمت آند، کلر گاز (Cl₂) تولید میشود و در سمت کاتد، هیدروکسید سدیم (NaOH) تولید میشود.
- ترکیب کلر گاز با آب: کلر گاز تولید شده از طریق مخلوط شدن با آب تبدیل به اسید هیدروکلریک (HClO₃) میشود.

- ترکیب کلرات سدیم: کلر گاز تبدیل شده به اسید هیدروکلریک با هیدروکسید سدیم تولید شده در مرحله الکترولیز بازکننده مخلوط میشود. این ترکیب موجب تولید کلرات سدیم (NaClO₃) میشود.
- جدا کردن کلرات سدیم: کلرات سدیم بهطور مجزا از محلول استخراج میشود و به صورت خالص دریافت میشود.
این فرآیند الکترولیز میتواند در مقیاسهای مختلف صورت بگیرد، از تولیدات کوچک مخصوص استفاده آزمایشگاهی تا فرآیندهای صنعتی بزرگ.
نتیجهگیری
کلراتها، به عنوان ترکیبات شیمیایی حاوی یون کلرات (ClO₃⁻)، در اکثر موارد از نظر صنعتی و شیمیایی بسیار مهم هستند. این ترکیبات از خواص اکسیدکننده برخوردار بوده و در صنایع مختلفی مورد استفاده قرار میگیرند.
در صنایع آتشنشانی، پالایش نفت، تولید کاغذ، صنایع غذایی، پزشکی و بهداشت، آبشویی و ضدعفونی کردن و دیگر صنایع، کلراتها به عنوان اکسیدکننده، عامل ضدعفونی کننده، و همچنین در فرآیندهای شیمیایی مورد استفاده قرار میگیرند.
با این حال، به دلیل خواص اکسیدکننده و خطرات مرتبط با آنها، استفاده از کلراتها باید با احتیاط و با رعایت نکات ایمنی صورت گیرد. افرادی که در تولید یا استفاده از این ترکیبات در صنایع مختلف فعالیت میکنند، باید آموزشهای لازم را دریافت کرده و از تجهیزات ایمنی مناسب استفاده کنند تا خطرات مرتبط با آنها کاهش یابد.
بنابراین، کلراتها به عنوان یکی از ترکیبات مهم و مفید در صنایع مختلف شناخته میشوند، اما باید با احتیاط و با رعایت نکات ایمنی لازم، استفاده شوند تا اثرات مخرب آنها بر روی سلامتی افراد و محیط زیست کاهش یابد.