نیترات باریم Barium nitrate نمکی متشکل از باریم و یون نیترات با فرمول مولکولی Ba(NO3)2 می باشد. این ماده از نظر فیزیکی به صورت جامدی سفید رنگ در دمای معمولی می باشد. کاربرد اصلی نیترات باریوم در امور نظامی نظیر تولید نارنجک های ترمیت و مهمات آتش زا می باشد.
عناوین مقاله
شاید برایتان جالب باشد که بدانید برای آتش بازی های سبز رنگ از نیترات باریم استفاده می کنند. این ماده نمکی از باریم و یون نیترات است و در صنعت و ساخت ترکیبات دیگر کاربردهای بسیاری دارد. این ماده با فرمول شیمیایی Ba(NO3)2 مانند سایر نمک های باریم، ماده ای سمی و محلول در آب است که با شعله سبز می سوزد و مانند سایر نیترات ها اکسید کننده است. به همین دلیل از آن در آتش بازی ها برای ایجاد رنگ سبز به همراه ترکیبات دیگر مانند کلرید سدیم برای ایجاد رنگ زرد و از کلرید مس برای رنگ آبی بهره می برند.
نگاهی به پیشینه کشف نیترات باریم
نیترات باریم اولین بار در سال 1808 توسط شیمیدان فرانسوی پیر-شارل لوبون کشف شد. لوبون با واکنش کربنات باریم با اسید نیتریک، نیترات باریم را سنتز کرد.

سنتز نیترات باریم:
BaCO3 + 2HNO3 → Ba(NO3)2 + H2O + CO2
لوبون با مطالعه خواص نیترات باریم، متوجه شد که این ماده می تواند برای تولید رنگ سبز در آتش بازی استفاده شود. او همچنین کشف کرد که نیترات باریم می تواند برای تصفیه شیشه و افزایش وضوح آن استفاده شود.
مشخصات فیزیکی و شیمیایی نیترات باریم
| ویژگی | مشخصات |
|---|---|
| فرمول شیمیایی | Ba(NO3)2 |
| جرم مولی | 261.32 g/mol |
| ظاهر | بلورهای سفید یا پودر کریستالی |
| نقطه ذوب | 592 درجه سانتیگراد |
| نقطه جوش | تجزیه می شود |
| حلالیت در آب | 34.4 گرم در 100 گرم آب در 100 درجه سانتیگراد |
| چگالی | 3.24 گرم بر سانتی متر مکعب |
| pH | 7.0 – 9.0 |
| طبقه بندی خطر | اکسید کننده، سمی |
نیترات باریم، با خواص اسیدی ضعیف است. برای تعیین ماهیت اسیدی نیترات باریم، می توانید کمی از این ترکیب را در آب حل کنید. این یک ترکیب بسیار محلول است که نباید با H۲O مخلوط شود. پس از حل شدن تمام نمک، یک نوار pH بردارید و آن را در محلول فرو کنید. نیترات باریم باید آن را به رنگ کمی زرد تغییر دهد. این نشان می دهد که این ترکیب کمی اسیدی است.
روش تهیه نیترات باریم
دو روش کلی برای تهیه نیترات باریم وجود دارد:
1. واکنش خنثی سازی: در این روش، از یک ترکیب باریم محلول مانند کربنات باریم یا هیدروکسید باریم و اسید نیتریک استفاده میشود. واکنش بین این دو ماده منجر به تولید نیترات باریم و آب میشود.
2. واکنش تبادل یونی: در این روش، از یک نمک باریم محلول مانند کلرید باریم و یک نمک نیترات محلول مانند نیترات سدیم یا نیترات نقره استفاده میشود. واکنش بین این دو ماده منجر به تولید نیترات باریم و یک نمک رسوبدهنده میشود.
این را هم بدانید که باراتول و TNT مواد انفجاری تولید شده توسط نیترات باریم هستند. از ترکیب نیترات باریوم با پودر آلومینیوم, پودر فلش تولید می شود که قابلیت انفجاری بالایی دارد.
ساختار نیترات باریم
نیترات باریم یک ترکیب یونی با فرمول شیمیایی Ba(NO3)2 است . در این ترکیب ، یون باریم (Ba2+) با دو یون نیترات (NO3-) پیوند یونی برقرار میکند .
ساختار بلوری:نیترات باریم بلورهایی با ساختار بلوری ortorhombic دارد. در این ساختار، یونهای باریم (Ba2+) و نیترات (NO3-) در یک شبکه بلوری منظم مرتب شدهاند. یونهای باریم توسط 12 یون نیترات احاطه شدهاند و ساختاری شبیه به لانه زنبوری ایجاد میکنند.
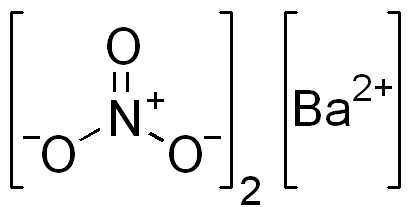
کاربردهای مختلف نیترات باریم
این ماده به عنوان منبع یون باریم در کاربردهای مختلف از جمله موارد زیر استفاده می شود:
#1آتش بازی: نیترات باریم برای تولید رنگ سبز در آتش بازی استفاده می شود. این کار با اضافه کردن نیترات باریم به مخلوطی از مواد دیگر مانند پودر منیزیم و کلرات پتاسیم انجام می شود. هنگامی که مخلوط مشتعل می شود، نیترات باریم شعله ای سبز ساطع می کند.
#2 لوله های پرتو کاتدی: نیترات باریم برای پوشش صفحه نمایش در لوله های پرتو کاتدی استفاده می شود. این پوشش به بهبود وضوح و روشنایی تصویر کمک می کند.
#3 شیشه: همچنین نیترات باریم برای تصفیه شیشه و افزایش وضوح آن استفاده می شود. این کار با حذف ناخالصی هایی مانند آهن و منگنز از شیشه انجام می شود.
#4 کاربردهای پزشکی: از دیگر کاربردهای نیترات باریم این است که در برخی از درمانهای پزشکی مانند درمان پوکی استخوان استفاده می شود. این کار با افزایش تراکم استخوان و کاهش خطر شکستگی انجام می شود.
سایر کاربردها: نیترات باریم همچنین در سایر کاربردها مانند تولید رنگدانه ها، جوندهکش(دفع موش و سایر جوندگان) ، سرامیک ، چاپ و عکاسی و مواد منفجره استفاده می شود. در برخی موارد می توان از این ترکیب برای تولید انواع پیشرانه نیز استفاده کرد .

نیترات باریم به تولید گلوله های ردیاب کمک می کند. وقتی گلوله شلیک میشود، میتوان مسیر دقیقی را که گلوله طی میکند دنبال کرد، به لطف یک شارژ Ba(NO 3 ) 2 که درست در انتهای چنین مهمات قرار میگیرد.این شارژ زمانی روشن می شود که چنین گلوله هایی از تفنگ شلیک شود. دود از این قسمت قابل مشاهده است که دقیقاً مسیر گلوله را نشان می دهد .
علاوه بر این، نیترات باریم یکی از ترکیبات اولیه در ایجاد شراره است که برای ارسال سیگنال به سربازان به یک مکان خاص استفاده می شود. در نهایت، چاشنی های انفجاری حاوی این ترکیب نیز هستند. به طور مشابه، نیترات باریم به دلیل ماهیت اکسید کننده آن جزء جدایی ناپذیر مواد منفجره است.
MSDS و نکات ایمنی نیترات باریم
خطرات: نیترات باریم می تواند با مواد قابل احتراق واکنش دهد و باعث آتش سوزی یا انفجار شود.این ترکیب در صورت بلع یا استنشاق می تواند مضر باشد. همچنین مهم است بدانید که نیترات باریم می تواند باعث تحریک چشم، پوست و مجاری تنفسی شود.
اقدامات احتیاطی: هنگام کار با نیترات باریم از عینک، دستکش و لباس محافظ استفاده کنید.نیترات باریم را در مکانی خنک، خشک و دور از مواد قابل احتراق نگهداری کنید.در صورت تماس با نیترات باریم، محل تماس را با آب فراوان بشویید.

علائم مسمومیت با نیترات باریم شامل این موارد می شود : تهوع،استفراغ،اسهال،درد شکم،ضعف عضلانی،فلج و تشنج
کمک های اولیه: در صورت بلع نیترات باریم، فوراً با اورژانس تماس بگیرید. اگر نیترات باریم با چشم شما تماس پیدا کرد، چشم ها را با آب فراوان به مدت 15 دقیقه بشویید. در صورت تماس نیترات باریم با پوست شما ، محل تماس را با آب فراوان بشویید. اگر این ترکیب سمی را استنشاق کردید، به هوای تازه بروید.
بازار خرید و فروش جهانی نیترات باریم
در سال 2022، ارزش بازار جهانی نیترات باریم 2.707.2 میلیون دلار بود.پیشبینی میشود تا سال 2028 به 3.586.7 میلیون دلار برسد.این رشد به دلیل افزایش تقاضا برای نیترات باریم در کاربردهای مختلف از جمله آتشبازی، لولههای پرتو کاتدی و شیشه است.بزرگترین کاربرد نیترات باریم آتش بازی است.
چین بزرگترین تولید کننده و مصرف کننده نیترات باریم در جهان است.آمریکای شمالی، اروپا و آسیا-اقیانوسیه سایر بازارهای مهم نیترات باریم هستند.
روش صحیح نگهداری و بستهبندی نیترات باریم

بستهبندی: نیترات باریم باید در ظروف دربسته و غیرقابل نفوذ نگهداری شود . جنس ظروف باید با نیترات باریم سازگار باشد .
ظروف نیترات باریم باید به طور واضح برچسبگذاری شوند . برچسب باید شامل نام ماده ، تاریخ تولید ، شماره باند و اطلاعات مربوط به خطرات باشد .
نگهداری: نیترات باریم را باید در مکانی خنک، خشک و دور از نور مستقیم خورشید نگهداری کرد. دمای مناسب برای نگهداری نیترات باریم بین 15 تا 25 درجه سانتیگراد است. نیترات باریم را باید دور از مواد قابل احتراق و مواد شیمیایی ناسازگار مانند اسیدها و فلزات قلیایی نگهداری کرد. محل نگهداری نیترات باریم باید به تهویه مناسب مجهز باشد.