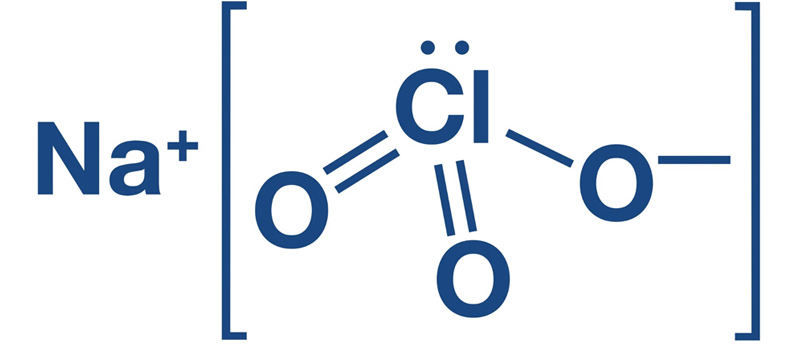
کلرات سدیم که با فرمول شیمیایی NaClO3 شناخته میشود، یک ترکیب معدنی غیرآلی است که از یک کاتیون سدیم (Na+) و یک آنیون کلرات (ClO3-) تشکیل شده است. این ماده به صورت بلورهای سفید یا بیرنگ با طعم شور و کمی تند وجود دارد. کلرات سدیم به راحتی در آب حل میشود و محلول آن کمی قلیایی است.
فهرست مطالب
(NaClO3) یک ترکیب شیمیایی با خصوصیات اکسیدکنندگی قوی است که عمدتاً در صنایع مختلف و برای مقاصد گوناگون مورد استفاده قرار میگیرد. در ادامه به معرفی ویژگیها، تولید، کاربردها، و نکات ایمنی مربوط به کلرات سدیم پرداخته میشود.
پیشینه کشف کلرات سدیم
کلرات سدیم (NaClO3)، که به عنوان سدیم کلرات نیز شناخته میشود، نخستین بار در اوایل قرن نوزدهم کشف شد. این ماده از طریق فرآیندهای الکتروشیمیایی، به خصوص الکترولیز محلولهای آبی نمکهای کلرید مانند نمک طعام (NaCl)، تولید میشود. تکنولوژی الکترولیز در آن زمان همچنان در حال توسعه بود و اکتشافات اصلی در این زمینه به سالهای بعد از کشف الکتریسیته و قوانین الکتروشیمی میرسند.
در قرن 19، پیشرفتهایی در فهم علمی و تکنیکی الکترولیز انجام شد. سایر دانشمندان نیز نقش مهمی در توسعه این فرآیند داشتند. سر آنتونی کارلایل و ویلیام نیکلسون، دو دانشمند بریتانیایی، در سال 1800 با استفاده از باتری ولتایی توانستند آب را الکترولیز کنند، که این امر نقش مهمی در شناخت بیشتر واکنشهای الکتروشیمیایی داشت.
ویژگی های کلرات سدیم
| ویژگی | مقدار |
|---|---|
| فرمول شیمیایی | NaClO₃ |
| جرم مولی | 106.42 گرم بر مول |
| حالت فیزیکی | بلورهای سفید یا بیرنگ |
| نقطه ذوب | 248 درجه سانتیگراد |
| نقطه جوش | 300 درجه سانتیگراد |
| چگالی | 2.49 گرم بر سانتی متر مکعب |
| حلالیت | 106 گرم در 100 گرم آب در 25 درجه سانتیگراد |
| طعم | شور و کمی تند |
| pH محلول | 7.5-8.5 |
| خواص شیمیایی | اکسید کننده قوی |
کلرات سدیم در طبیعت به طور طبیعی یافت نمی شود و به طور مصنوعی تولید می شود.همچنین این ترکیب وقتی به شدت گرم میشود، به کلرید سدیم و اکسیژن تجزیه میشود، که این فرآیند میتواند خطرناک باشد و منجر به واکنشهای انفجاری شود.
کلرات سدیم با مواد قابل احتراق مانند شکر یا پودر آلومینیوم واکنش می دهد و این ترکیبات میتوانند بسیار حساس و خطرناک باشند. به همین دلیل در برخی از کشورها به دلیل پتانسیل استفاده در مواد منفجره تحت کنترل است.
تهیه و تولید کلرات سدیم
کلرات سدیم از الکترولیز آب شور ساده (کلرید سدیم و آب) تولید می شود.
این فرآیند در طبیعت گرمازا است. در چند مرحله رخ می دهد.همچنین، تغییرات pH و دما در تولید آن موثر است.
تهیه کلرات سدیم بسیار ساده است، گاز کلر (Cl2) در آند و گاز هیدروژن (H2) در کاتد ذخیره می شود. سپس کلر در سلول به یک گروه آنیون هیپوکلریت هیدرولیز می شود که در آن نقطه کلرات سدیم تولید می کند.
ذرات کلرات سدیم به شکل کریستال تشکیل می شوند. محلول به دست آمده پس از هیدرولیز اغلب مایع سلولی نامیده می شود. سپس محلول از دستگاه خارج می شود. کریستال های به دست آمده شسته و خشک می شوند و در یک منطقه خشک نگهداری می شوند. بسته به کاربرد، ممکن است به صورت کریستال یا مایع فروخته شود.
ساختار کلرات سدیم
کلرات سدیم (NaClO₃) یک ترکیب یونی است که از یونهای سدیم (Na⁺) و کلرات (ClO₃⁻) تشکیل شده است. در ساختار کریستالی کلرات سدیم، هر یون سدیم به طور معمول توسط شش یون کلرات احاطه شده است که یک هندسه اکتائدریک را تشکیل میدهند. هر یون کلرات نیز به طور مشابه توسط شش یون سدیم احاطه شده، که این هندسه سبب پایداری بالای ساختار کلی میشود.
در یون کلرات (ClO₃⁻)، اتم کلر در مرکز قرار دارد و سه اتم اکسیژن به آن متصل هستند، به صورتی که یک هندسه سهوجهی تخت ایجاد میکنند. این ساختار باعث میشود که یون کلرات نسبتاً سمتی باشد، و این خصوصیت در واکنشهای شیمیایی آن نقش مهمی دارد.
ساختار بلوری کلرات سدیم در دمای اتاق به صورت مکعبی و با فضایی گروهی مکعبی وجه مرکزی (Fm3m) است. این ساختار به این معنی است که هر نقطه در شبکه بلوری به یکنواختی توسط اتمهای مجاور احاطه شده است، که استحکام بلور و خصوصیات فیزیکی آن مانند نقطه ذوب بالا و استحکام مکانیکی را تعیین میکند.
کاربردهای کلرات سدیم
کلرات سدیم (NaClO3)، به دلیل خواص اکسیدکنندهی قویاش، در بسیاری از صنایع و کاربردهای گوناگون مورد استفاده قرار میگیرد. در زیر به برخی از این کاربردها اشاره میکنم:
کشاورزی
- هربیسید: سدیم کلرات به عنوان یک هربیسید نسبتاً ارزان برای کنترل علفهای هرز در کشاورزی استفاده میشود. این ماده به خصوص برای از بین بردن علفهای هرز در مزارع پنبه و چغندر قند مفید است.
صنایع شیمیایی
- تولید پرکلراتها: سدیم کلرات در تولید پرکلراتها، که در صنعت فضایی و به عنوان مواد منفجره استفاده میشوند، به کار برده میشود.
- واکنشهای شیمیایی: به عنوان یک اکسیدکننده در واکنشهای شیمیایی مختلف استفاده میشود.
صنایع منفجره
- مواد منفجره: سدیم کلرات به دلیل خواص اکسیدکنندهی قوی، در ترکیبات برای تولید برخی مواد منفجره استفاده میشود.
کاربردهای دیگر
- پالپ و کاغذ: در فرآیند بلیچینگ (سفیدکردن) پالپ و کاغذ استفاده میشود.
- پردازش معادن: برای استخراج مواد معدنی و فلزات از سنگ معدن استفاده میشود، که میتواند به بهبود بازیابی فلزات کمک کند.
- آتشبازی و مواد نورافشان: به عنوان اکسیدکننده در تولید آتشبازی و مواد نورافشان به کار رفته و به تولید رنگها و اثرات نوری کمک میکند.
خطرات و ملاحظات ایمنی کلرات سدیم
استفاده از کلرات سدیم به دلیل خواص اکسیدکنندهاش، مخاطراتی را به همراه دارد و نیاز به رعایت ملاحظات ایمنی دارد. در زیر به برخی از خطرات و ملاحظات ایمنی مرتبط با کار با کلرات سدیم اشاره میشود:
سوختن و انفجار: کلرات سدیم یک اکسیدکننده قوی است که با مواد قابل احتراق و واکنش پذیر به شدت واکنش دارد. تماس این ماده با مواد قابل احتراق مانند گل و پودر آلومینیوم میتواند منجر به واکنشهای ناپیشبینی و حتی انفجار شود.
سمیت: مصرف بالای کلرات سدیم میتواند سمیت زیادی داشته باشد و موجب عوارض جدی بر سلامتی انسانها شود. در صورت بلعیده شدن یا تماس با پوست، ممکن است عوارض جدی مانند تحریک پوست، سوزش، آسیبهای دستگاه گوارشی و حتی مسمومیت سیستمیک را ایجاد کند.
تدابیر ایمنی: هنگام کار با کلرات سدیم، باید تدابیر ایمنی مناسب اتخاذ شود. این شامل استفاده از لباس محافظ، دستکش، عینک و ماسک مخصوص، همچنین اجرای عملیات در محیطهای خنثی و خنک میشود. همچنین باید از تماس با مواد قابل احتراق و جلوگیری از ایجاد ترکیبات خطرناک پرهیز کرد.
ذخیرهسازی ایمن: کلرات سدیم باید در ظروف مناسب و در محیطهای خنک، خشک و محافظت شده از نور مستقیم نگهداری شود. همچنین باید از مخلوط شدن این ماده با مواد قابل احتراق و واکنش پذیر دیگر پرهیز شود.
در کل، استفاده از کلرات سدیم به علت خطراتی که دارد، نیازمند آگاهی کامل از مخاطرات و رعایت ملاحظات ایمنی است. همچنین، در صورتی که از این ماده در کارخانهها یا صنایع استفاده میشود، باید دستورالعملها و مقررات ایمنی مربوطه را رعایت کرد تا از وقوع حوادث و آسیبهای جسمانی جلوگیری شود.
چگونگی بازار فروش کلرات سدیم
بازار فروش کلرات سدیم به طور عمده توسط شرکتهای شیمیایی و تولید کنندگان مواد شیمیایی اداره میشود. این محصول در انواع صنعتی و تجاری در دسترس است و به عنوان یک ماده شیمیایی اساسی در صنایع مختلف مورد استفاده قرار میگیرد.
تولیدکنندگان اصلی کلرات سدیم در سراسر جهان عبارتند از: چین، هند، ایالات متحده آمریکا، اروپا و ژاپن. که البته چین بزرگترین تولیدکننده و صادرکننده کلرات سدیم در جهان است.
قیمت کلرات سدیم تا حد زیادی به قیمت مواد اولیه، به ویژه نمک طعام (NaCl) و هزینههای انرژی بستگی دارد.رقابت در بازار کلرات سدیم شدید است و قیمت، کیفیت و خدمات مشتری عوامل کلیدی برای موفقیت در این بازار هستند.انتظار میرود که بازار کلرات سدیم در سالهای آینده به رشد متوسطی برسد.