پتاسیم یک عنصر شیمیایی است که در جدول تناوبی با نماد K و عدد اتمی ۱۹ قرار دارد. این فلز نرم، سفید-نقرهای، در شرایط استاندارد به صورت جامد و قابل انعطاف است. پتاسیم یکی از عناصر فلزی قلیایی است و اکثراً در طبیعت به صورت ترکیبات موجود است.
این عنصر به شدت واکنشپذیر است و به سرعت در هوا اکسید میشود. پتاسیم در آب به سرعت واکنش نشان میدهد و هیدروکسید پتاسیم (KOH) و گاز هیدروژن تولید میکند.
پتاسیم با بسیاری از عناصر و ترکیبات دیگر واکنش میدهد و نمکهای پتاسیم را تشکیل میدهد. پتاسیم یک کاهنده قوی است.ترکیبات پتاسیم در طبیعت و همچنین در کاربردهای صنعتی و کشاورزی یافت میشوند.
فهرست مطالب مقاله
این عنصر حدوداً ۲٫۴٪ از وزن پوسته زمین را تشکیل میدهد و از نظر فراوانی هفتمین عنصر در آن میباشد. به دست آوردن پتاسیم از کانیها به دلیل خاصیت نامحلولی و ماندگاری آن بسیار دشوار است.
پیدایش پتاسیم
پیدایش پتاسیم در زمین به دلایل مختلفی اتفاق میافتد. در اینجا چند مورد از این دلایل ذکر میشود:
پیدایش در فرآیندهای زمینشناسی: پتاسیم معمولاً در سنگها و مواد معدنی موجود در پوسته زمین یافت میشود. این عنصر در زمانهای گذشته به واسطه فعالیتهای زمینشناسی، مانند آتشفشانها، فعالیتهای زمینلرزه و پوسیدگی سنگها، از مواد مختلفی که در عمق زمین وجود داشتهاند، آزاد شده است.
تجزیه و تحلیل سنگها: سنگها که حاوی پتاسیم هستند، تحت تأثیر عوامل مختلفی مانند آب، هوا، و فرایندهای شیمیایی و فیزیکی دیگر قرار میگیرند که باعث تجزیه و آزاد شدن پتاسیم موجود در آنها میشود.
روند هیدرولیز سنگها: در این فرآیند، آب و ترکیبات شیمیایی موجود در آن به طور تدریجی با سنگها و مواد معدنی واکنش میدهند و پتاسیم موجود در آنها را آزاد میکنند.
روند آهکسازی: در فرآیند آهکسازی، سنگهایی که حاوی کربناتهای پتاسیم هستند، تحت تأثیر آب و اسیدهای موجود در زمین قرار میگیرند و پتاسیم آزاد شده در آب حل شده و به منابع آبی میرسد.
این فرآیندها به صورت طبیعی در زمین رخ میدهند و باعث پیدایش و توزیع پتاسیم در محیط زیست میشوند.
خواص و ویژگیهای پتاسیم
| خاصیت | مقدار | واحد |
|---|---|---|
| نام شیمیایی | پتاسیم | – |
| نماد شیمیایی | K | – |
| عدد اتمی | 19 | – |
| جرم اتمی | 39.0983 | u |
| نقطه ذوب | 63.55 °C | °C |
| نقطه جوش | 760 °C | °C |
| چگالی | 0.894 g/cm³ | g/cm³ |
| حالت فیزیکی | جامد | – |
| رنگ | سفید-نقرهای | – |
| ساختار اتمی | [18]8s1 | – |
اهمیت پتاسیم در طبیعت
پتاسیم یکی از عناصر ضروری برای زندگی در طبیعت است و اهمیت آن در محیط زیست بسیار بالاست. در زیر به برخی از اهمیتهای پتاسیم در طبیعت اشاره میشود:
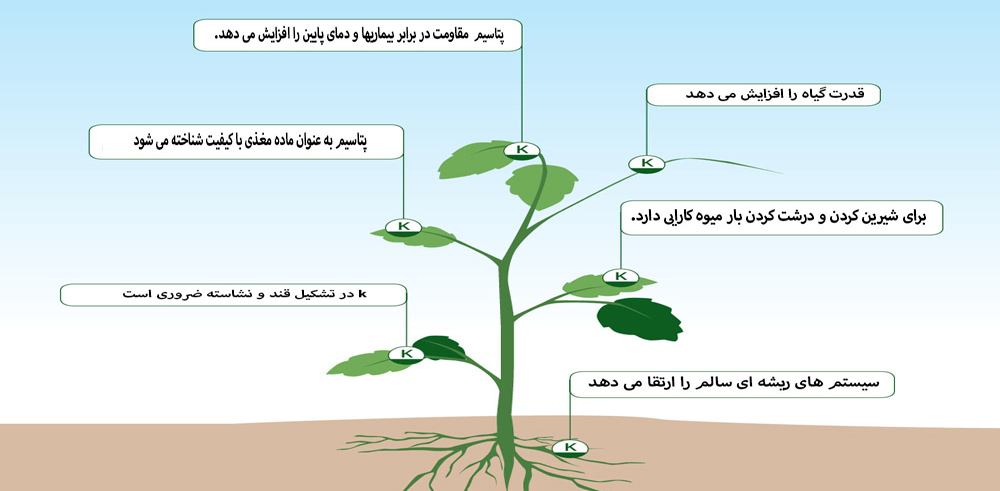
- رشد و توسعه گیاهان: پتاسیم یکی از عناصر غذایی اصلی برای رشد و توسعه گیاهان است. این عنصر به عنوان یک نیازمندی اساسی برای فعالیت سلولی و تولید انرژی در گیاهان عمل میکند. همچنین، پتاسیم باعث تقویت ساختار سلولی، تنظیم فعالیت آبگیری و کمک به مقاومت گیاهان در برابر تنشهای محیطی میشود.
- چرخه پتاسیم در اکوسیستمها: پتاسیم به طور مداوم بین گیاهان، خاک، آب و موجودات زنده در چرخهای پیچیده در گردش است.
- تاثیر بر آب و هوا: ترکیبات پتاسیم در اتمسفر میتوانند بر تشکیل ابر و بارش تأثیر بگذارند.
- تنظیم فرایندهای فیزیولوژیکی: پتاسیم در گیاهان به عنوان یک نقشهبردار اصلی در تنظیم فعالیتهای فیزیولوژیکی، از جمله تقسیم سلولی، تولید و ترکیب پروتئین، و ساختار داخلی گیاهان عمل میکند.
- تعادل اسید و باز: پتاسیم نقش مهمی در تعادل اسید و باز در گیاهان دارد. این عنصر باعث کنترل pH داخلی سلولها و بافتهای گیاهی میشود که برای فعالیتهای بیوشیمیایی اساسی و جذب عناصر غذایی توسط گیاهان ضروری است.
- حفظ بومشناختی: پتاسیم در اکوسیستمها نقش مهمی در حفظ تنوع زیستی، توازن بومشناختی و پایداری محیط زیست دارد، زیرا تأثیر مستقیمی بر رشد و توسعه گیاهان و سایر ارگانیسمهای زنده دارد.
به طور کلی، پتاسیم به عنوان یکی از عناصر ضروری در زندگی گیاهان و ارتباطات بینزیستی در محیط زیست باعث حفظ تنوع و پایداری زیستی میشود.
ترکیبات شیمیایی پتاسیم
ترکیبات پتاسیم، مجموعهای از ترکیبات شیمیایی هستند که شامل پتاسیم به عنوان عنصر اصلی میباشند. این ترکیبات به طور گسترده در صنایع مختلف و همچنین در کشاورزی مورد استفاده قرار میگیرند. در زیر به برخی از ترکیبات پتاسیم مهم اشاره میشود:
1.کلرید پتاسیم (KCl): رایجترین ترکیب پتاسیم که به عنوان “موریت پتاس” یا “نمک مورتریت” نیز شناخته میشود، در کشاورزی به عنوان کود پتاسه استفاده میشود. همچنین در مواد غذایی به عنوان جایگزین نمک طعام و در الکترولیز برای تولید پتاسیم فلزی استفاده میشود.الکترولیز کلرید پتاسیم، باعث تولید هیدروکسید پتاسیم میشود که به راحتی رطوبت را جذب میکند .

2.سولفات پتاسیم (K2SO4): یک کود معدنی است که به عنوان منبع پتاسیم و گوگرد برای گیاهان استفاده میشود. به عنوان “سولفات پتاس” یا “نمک شونیت” نیز شناخته میشود، در کشاورزی به عنوان کود پتاسه، در تولید شیشه و در صنایع دارویی استفاده میشود.
3.نیترات پتاسیم (KNO3): یک نمک دوپتاسیمیوم نیترات است که به عنوان یک منبع نیتروژن و پتاسیم در کودهای گیاهی استفاده میشود. به عنوان “نمک نیترات” یا “شوره نمک” نیز شناخته میشود، در مواد منفجره، کودها، شیشه و صنایع غذایی استفاده میشود.
4.کربنات پتاسیم (K2CO3): یک نمک آلکالی است که به عنوان یک منبع پتاسیم در صنایع شیمیایی مورد استفاده قرار میگیرد، به عنوان “پتاس” یا “زاج خاکستری” نیز شناخته میشود، در تولید شیشه، سرامیک و صنایع غذایی استفاده میشود.
5.هیدروکسید پتاسیم (KOH): پتاس سوزاننده، باز قوی با کاربردهایی در تولید صابون، مواد شوینده، باتریها و تصفیه آب. همچنین، واکنش ید و هیدروکسید پتاسیم باعث تولید یدید پتاسیم (KI) میشود که برای محافظت در برابر کمبود ید در خوراکیها و خوراک دام استفاده میشود. این ترکیب معمولاً به نمک خوراکی و خوراک دام اضافه میشود تا کمبود ید در بدن حیوانات را تأمین کند.
این ترکیبات از تنوع استفادههای پتاسیم در صنایع مختلف و کشاورزی نشان میدهند. پتاسیم در ترکیبات مختلفی مانند کربنات، سولفات، و نیترات ها به صورت آنیون یافت می شود و نقش مهمی در صنایع مختلف، از جمله کشاورزی، صنایع شیمیایی و پزشکی، دارد.
از ترکیبات پتاسیم در ساخت مواد منفجره به عنوان کاتیون موثر در ترکیبات انفجاری استفاده میشود. برخی از ترکیبات پتاسیم که به عنوان مواد منفجره مورد استفاده قرار میگیرند شامل پتاسیم کلرات (KClO3) و پتاسیم پرمنگنات (KMnO4) است. این ترکیبات به دلیل ویژگیهای شیمیایی خاص خود، از جمله اکسیدان بودن و قابلیت تفکیک واکنشی، در ترکیبات منفجره استفاده میشوند.
اما در مقایسه با کاربردهای پتاسیم در کشاورزی و صنایع دیگر، کاربردهای مواد منفجره از ترکیبات پتاسیم به میزان کمتری است. این عوامل به دلیل اهمیت بیشتر و گستردهتر کاربردهای دیگر پتاسیم در صنایع مختلف است که بر زراعت، تولید مواد غذایی، و صنایع شیمیایی تأثیر بسزایی دارد.
مقایسه پتاسیم و سدیم
اگرچه پتاسیم و سدیم هر دو فلز قلیایی هستند و خواص شیمیایی مشابهی دارند، تفاوت های قابل توجهی نیز بین آنها وجود دارد.
شباهت ها:
- ظاهر: هر دو فلز نرم، سفید-نقره ای و براق هستند.
- واکنش پذیری: هر دو به شدت واکنش پذیر هستند و به سرعت با آب، اکسیژن و هالوژن ها واکنش نشان می دهند.
- تشکیل نمک ها: هر دو با عناصر دیگر واکنش نشان می دهند و نمک های یونی تشکیل می دهند.
- نقش زیستی: هر دو برای سلامت انسان ضروری هستند و نقش های مهمی در عملکرد سلولی دارند.

تفاوت ها:
- واکنش پذیری: پتاسیم به طور قابل توجهی از سدیم واکنش پذیرتر است. به عنوان مثال، پتاسیم با گرافیت واکنش نشان می دهد، در حالی که سدیم اساساً واکنش نشان نمی دهد.
- ترکیبات بین لایه ای: پتاسیم می تواند ترکیبات بین لایه ای با گرافیت تشکیل دهد، در حالی که سدیم نمی تواند.
- کربونیل: پتاسیم با مونوکسید کربن واکنش می دهد و یک کربونیل انفجاری (K6C6O6) تشکیل می دهد، در حالی که سدیم این کار را نمی کند.
- حلالیت: پتاسیم مایع و NaK هر دو نسبت به سدیم مایع با هوا و اکسیژن واکنش بیشتری دارند.
- واکنش با آب: پتاسیم به شدت با آب واکنش می دهد و هیدروژن تولید می کند، در حالی که سدیم واکنش ملایم تری دارد.
- ذخیره سازی: پتاسیم را می توان بدون واکنش در گاز نیتروژن ذخیره کرد، در حالی که سدیم باید در روغن یا پارافین ذخیره شود.
- واکنش با هالوژن ها: پتاسیم به شدت با هالوژن ها واکنش نشان می دهد و در تماس با برم مایع منفجر می شود، در حالی که سدیم واکنش کمتری دارد.
- واکنش با دی اکسید کربن: پتاسیم دی اکسید کربن را در دماهای بالا به مونوکسید کربن و کربن کاهش می دهد، در حالی که سدیم این کار را نمی کند.
- واکنش با بنزن: پتاسیم با بنزن واکنش نشان نمی دهد، در حالی که فلزات قلیایی سنگین تر مانند سزیم واکنش نشان می دهند.

عوامل موثر بر تفاوت ها:
- اندازه اتمی: پتاسیم شعاع اتمی بزرگتری نسبت به سدیم دارد، که منجر به افزایش واکنش پذیری آن می شود.
- آرایش الکترونی: پتاسیم یک الکترون بیشتر در پوسته ظرفیت خود نسبت به سدیم دارد که بر واکنش پذیری آن تأثیر می گذارد.
- انرژی یونیزاسیون: پتاسیم انرژی یونیزاسیون پایین تری نسبت به سدیم دارد که به معنای جداسازی آسان تر الکترون ها و افزایش واکنش پذیری آن است.